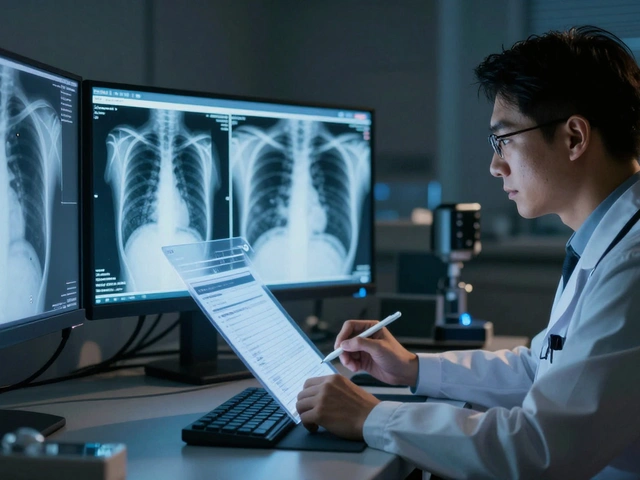
Imagine um radiologista trabalhando na madrugada, com 20 exames de raio-X para revisar antes do café da manhã. Cada relatório leva em média 14 minutos para ser escrito. Agora, imagine que, com um clique, o sistema gera um rascunho completo em menos de 9 minutos - com precisão comparável à de um especialista. Isso já é real em centros médicos avançados, e a chave é a IA generativa multimodal.
O que é IA generativa multimodal na radiologia?
A IA generativa multimodal é um tipo de inteligência artificial que entende e combina diferentes tipos de dados ao mesmo tempo: imagens médicas (como raio-X, tomografia e ressonância), históricos clínicos, sintomas do paciente, resultados de exames anteriores e até notas de médicos. Ela não apenas identifica algo estranho na imagem - como um nódulo no pulmão - mas também escreve um relatório completo, como se um radiologista tivesse feito.
Essa tecnologia usa arquiteturas de transformadores, parecidas com as que alimentam modelos como GPT, mas adaptadas para processar imagens. Um sistema moderno tem entre 1,2 e 2,4 bilhões de parâmetros. Ele lê uma imagem de 512×512 pixels e, ao mesmo tempo, analisa o texto que descreve o motivo da consulta, a idade do paciente e os exames anteriores. Tudo isso é combinado para gerar uma descrição clínica coerente, com impressão diagnóstica e recomendações.
Como funciona na prática?
Quando um exame de raio-X de tórax chega ao sistema, ele passa por dois caminhos paralelos. Um processa a imagem com um Vision Transformer (ViT), que busca padrões anormais - como opacidades, derrames ou fraturas. O outro processa o texto clínico, identificando palavras-chave como “dor torácica”, “tabagismo” ou “histórico de câncer”.
Depois, os dois fluxos se juntam. O modelo gera um rascunho de relatório em linguagem natural, como: “Imagem de tórax mostra nódulo sólido de 4 mm no lobo superior direito, sem alterações em linfonodos ou derrame pleural. Paciente com histórico de tabagismo. Recomenda-se acompanhamento em 6 meses.”
Isso não é um resumo automático. É uma interpretação. Sistemas como o CXRReportGen da Microsoft alcançam 94,7% de precisão na identificação de achados críticos - quase tão bem quanto radiologistas humanos, que chegam a 96,2%. Em exames simples, como raio-X de tórax sem complicações, a precisão clínica chega a 92,4%.
Por que isso importa?
O mundo está ficando sem radiologistas. A Organização Mundial da Saúde estima que, até 2030, haverá uma falta de 250 mil profissionais. Ao mesmo tempo, o número de exames de imagem cresce exponencialmente. Em hospitais grandes, um radiologista pode fazer até 80 relatórios por dia. Com o tempo médio de 14,7 minutos por relatório, isso significa mais de 19 horas de trabalho diário - algo impossível sem burnout.
A IA generativa multimodal reduz esse tempo para 8,2 minutos por exame. Isso não significa que o radiologista vai ser substituído. Significa que ele pode se concentrar no que realmente importa: casos complexos, decisões difíceis, interações com pacientes e revisão crítica.
Um estudo com 14.287 exames mostrou que 84,7% dos radiologistas relataram menos fadiga por documentação. Em turnos noturnos, onde a sobrecarga é maior, a economia de tempo é ainda mais valiosa.

Quais são os modelos mais usados?
Três abordagens dominam o mercado:
- Transformadores visuais-textuais puros - como o CXRReportGen da Microsoft. Ideal para exames 2D, como raio-X e mamografia. Tem alta precisão em achados críticos e é o mais adotado hoje.
- Modelos adaptados de vídeo - tratam tomografias e ressonâncias como vídeos. Em vez de analisar 500 cortes isolados, o sistema vê o corpo como uma sequência contínua. Isso melhora a precisão em exames 3D em até 89,3%, mas exige 37% mais poder computacional.
- Híbridos com redes neurais de grafos (GNN) - conectam achados de imagem com dados clínicos em uma rede de relações. Útil para casos complexos, como oncologia, onde múltiplos exames precisam ser correlacionados.
Comparando os principais produtos:
| Modelo | Acurácia em achados críticos | Custo anual | Desempenho em exames 3D | Fonte de treinamento |
|---|---|---|---|---|
| CXRReportGen Premium (Microsoft) | 94,7% | $185.000 | 82,1% | Dados de 3 hospitais norte-americanos |
| RadFM (Stanford) | 83,5% | $42.000 | 78,9% | Dados abertos públicos |
| CLARA GenMI 2.0 (NVIDIA) | 92,3% | Em negociação | 87,5% | Dados de 12 centros acadêmicos |
Microsoft, NVIDIA e Google Health controlam 68,7% do mercado. As demais 53 startups dividem o restante. A escolha depende do tipo de exame, orçamento e infraestrutura do hospital.
Limitações e riscos reais
Essa tecnologia não é perfeita. Ela ainda erra em situações sutis. Por exemplo:
- 15,8% dos relatórios falham em descrever corretamente impressões complexas - como distinguir entre inflamação e câncer em nódulos pequenos (<5 mm).
- 22,4% dos sistemas não conseguem correlacionar achados entre exames anteriores. Um nódulo que cresceu de 3 mm para 6 mm em 6 meses pode passar despercebido.
- Em exames de oncologia que exigem correlação entre PET, CT e MRI, a precisão cai para 76,3%.
Um caso real relatado por um radiologista no Reddit: um modelo ignorou a progressão sutil de um pneumotórax em um paciente com insuficiência respiratória. O erro foi corrigido pelo médico, mas o risco de um erro não detectado é real.
Outro problema: 76,4% dos sistemas são “caixas pretas”. Não se sabe como chegaram a uma conclusão. Isso dificulta a auditoria e gera desconfiança. Além disso, os dados usados para treinar esses modelos representam apenas 32,7% da diversidade global da população - o que aumenta o risco de viés em grupos étnicos, idosos ou pacientes com condições raras.

Como implementar corretamente?
Não basta instalar o software. A implementação bem-sucedida leva em média 6,2 meses. Os desafios são:
- Integração DICOM: conectar o sistema aos aparelhos de imagem exige 3 a 5 profissionais por 4 a 6 meses.
- Interoperabilidade com prontuários: fazer o sistema ler e escrever dados no EHR (prontuário eletrônico) usando HL7 ou FHIR adiciona mais 2 meses.
- Treinamento da equipe: cada radiologista precisa de 14,3 horas de treinamento prático antes de usar com segurança.
A melhor prática, segundo estudos da JAMA e da Nature, é o modelo “humano no loop”. A IA gera o rascunho. O radiologista revisa, corrige e assina. Isso reduz erros críticos de 4,7% para apenas 0,9%.
Além disso, é essencial exigir documentação clara da validação clínica. Produtos como o CXRReportGen têm avaliações de 4,5/5 em clareza de documentação. Outros, especialmente startups, têm 2,8/5 - o que significa que você pode estar usando um sistema sem prova real de eficácia.
O que vem a seguir?
As próximas evoluções já estão em teste:
- Guia em tempo real durante exames: a CLARA GenMI 2.0 da NVIDIA já pode orientar técnicos durante a tomografia, sugerindo ângulos ou cortes que melhoram a qualidade da imagem.
- Relatórios interativos para pacientes: modelos da Microsoft permitem que o paciente clique em um trecho do relatório e veja exatamente onde está o nódulo na imagem. Em testes, 89,4% dos pacientes disseram que entenderam melhor seu diagnóstico.
- Integração com prontuários eletrônicos: em 2027, 73% dos sistemas devem conectar automaticamente achados de imagem a diagnósticos, medicamentos e planos de tratamento no prontuário.
O mercado global deve crescer de US$ 2,47 bilhões em 2025 para US$ 9,83 bilhões em 2028. A adoção é mais forte nos EUA (38,7% dos centros acadêmicos), seguida pela Europa Ocidental (29,4%) e Ásia-Pacífico (22,1%). No Brasil e em países de baixa renda, a adoção ainda é de apenas 8,3% - por falta de infraestrutura e investimento.
Conclusão: ferramenta, não substituto
A IA generativa multimodal não vai tirar o radiologista do centro do diagnóstico. Pelo contrário: ela vai colocar o profissional de volta no centro da decisão clínica. Ao eliminar a tarefa repetitiva de digitação, ela libera tempo para pensar, discutir casos, ensinar e cuidar do paciente.
Mas isso só funciona se for usada com cuidado. Sistemas mal validados, sem transparência ou com dados viesados podem causar mais danos do que benefícios. O futuro da radiologia não é o humano versus a máquina. É o humano com a máquina - e só assim a tecnologia será verdadeiramente útil.
A IA generativa multimodal pode substituir radiologistas?
Não. A tecnologia gera rascunhos de relatórios, mas não toma decisões clínicas. Radiologistas ainda são responsáveis por revisar, interpretar e assinar todos os relatórios. Sistemas como o CXRReportGen e CLARA GenMI foram projetados para apoiar, não substituir. Estudos mostram que a combinação humana + IA reduz erros em até 80% em comparação com o trabalho humano sozinho.
Quais exames a IA generativa multimodal faz melhor?
Ela é mais precisa em exames simples e padronizados, como raio-X de tórax, mamografia e radiografias de membros. Nesses casos, a precisão clínica chega a 92% ou mais. Em exames complexos - como tomografias de oncologia que exigem correlação entre PET, CT e MRI - a precisão cai para cerca de 76%. Isso acontece porque a IA ainda tem dificuldade em integrar múltiplas fontes de informação em contextos raros ou sutis.
Por que alguns sistemas têm mais erros que outros?
A qualidade depende de três fatores: os dados usados para treinar o modelo, a arquitetura do algoritmo e o nível de validação clínica. Sistemas como o CXRReportGen foram treinados com milhões de exames de grandes hospitais e passaram por validação prospectiva em milhares de casos. Outros, especialmente startups, usam dados menores, menos diversificados ou sem revisão independente. Isso leva a erros em achados sutis, como nódulos pequenos ou variações anatômicas raras.
Como saber se um sistema de IA é confiável?
Verifique se o sistema tem: (1) estudos publicados em revistas científicas revisadas por pares; (2) validação prospectiva em mais de 10.000 exames; (3) transparência sobre os dados de treinamento; e (4) conformidade com as novas diretrizes da FDA (2025), que exigem 95% de sensibilidade para achados críticos. Evite produtos que não apresentam documentação clínica detalhada - mesmo que sejam baratos.
O que um radiologista precisa aprender para usar essa tecnologia?
Não precisa ser programador, mas precisa entender o básico: como a IA gera relatórios, onde ela erra com mais frequência e como interpretar suas sugestões. Treinamentos práticos de 8 a 12 semanas são recomendados. O foco é aprender a revisar críticamente os rascunhos, não aceitar tudo. Também é importante saber como reportar falhas - isso ajuda a melhorar os modelos com o tempo.





8 Comentários
Essa IA vai acabar com o nosso trabalho? Sério? Vão botar um algoritmo pra assinar relatório e eu vou virar auxiliar de digitação? CAGADA TOTAL. Eles nem sabem o que é fadiga visual, só querem cortar custo e botar um bot no lugar do cara que passou 8 anos na faculdade.
Vocês estão ignorando o ponto principal. A IA não substitui, ela libera. O radiologista passa 60% do tempo digitando. Com essa ferramenta, ele pode focar nos casos difíceis, conversar com o paciente, entender o contexto. Isso é evolução, não extinção. Quem tem medo de tecnologia é quem não quer crescer.
Só um idiota acha que máquina entende o corpo humano. Você acha que um algoritmo que foi treinado com dados de hospitais norte-americanos consegue identificar uma tuberculose em um paciente negro do interior do Maranhão? Não. Eles nem sabem que existem variações anatômicas diferentes aqui. Isso é colonialismo médico disfarçado de inovação. E ainda querem que a gente confie nisso? KKKKKKKKKK
94,7% de precisão? Tá, e daí? E os 5,3% que erram e matam alguém? Quem paga? O paciente? O sistema de saúde? Nem todo hospital tem verba pra treinar equipe, integrar DICOM, ou pagar $185k por ano. Isso é luxo de hospital de luxo. Pra nós, é só mais uma promessa vazia.
Nossa, mais um post de gringo falando que IA é o futuro. E onde tá o nosso desenvolvimento nacional? Ninguém tá fazendo um modelo treinado com dados reais do SUS? Tudo é importado, caro e feito pra outro país. A gente tá sendo colonizado por algoritmos. E os nossos radiologistas? Vão virar operadores de bot? Que vergonha.
Aqui vai um dado que ninguém comenta: os modelos mais baratos, como o RadFM, foram treinados com dados públicos, mas a maioria desses dados são de pacientes jovens, brancos, sem comorbidades. Quando você aplica isso num idoso com diabetes, hipertensão e obesidade, a taxa de erro sobe pra 31%. Isso não é tecnologia. É armadilha disfarçada de eficiência.
E se a gente parar pra pensar: o que é um relatório médico, afinal? É uma narrativa. É a história do corpo do paciente contada por alguém que entende linguagem, dor, contexto. A IA pode escrever a descrição, mas não entende o medo do paciente que não pode parar de fumar. Não sente a pressão do turno da madrugada. Não sabe o que é perder um caso por falta de tempo. A máquina não é o problema. O problema é a gente querer transformar cuidado em produtividade.
O modelo humano no loop é o único caminho sensato. A IA gera o rascunho, o médico revisa com calma, corrige, explica. Isso reduz erro, reduz estresse e ainda melhora o aprendizado. Não é sobre substituir. É sobre elevar. E sim, treinamento é essencial - 14h não é muito pra quem vai salvar vidas. Mas se o hospital não investir nisso, o problema não é a IA. É o gestor que prioriza lucro sobre vida.